Разница между ацетоном и водой (с таблицей)
Ацетон и вода по-своему разные, в зависимости от их прозрачности, запаха, цвета, вкуса. Но оба важны по-своему, и поэтому становится необходимым понять, что такое ацетон и вода, хорошо различать их и понимать их важность в живых организмах.
Ацетон против водыОсновное различие между ацетоном и водой заключается в том, что ацетон — это простейший кетон со специфическим запахом, а вода — это неорганическое соединение, не имеющее запаха.
Ацетон естественным образом встречается в окружающей среде в растениях, деревьях, лесных пожарах, выхлопных газах автомобилей, а также как продукт распада метаболизма животных жиров и представляет собой промышленное химическое вещество со специфическим запахом и вкусом. Он не имеет цвета и довольно легко испаряется. Ацетон легко воспламеняется и может растворяться в воде.
Вода является одним из наиболее важных соединений для выживания человека. Он состоит из химических элементов водорода и кислорода и существует в твердом, жидком и газообразном состояниях. Не имеет вкуса и запаха при комнатной температуре. Вода обладает способностью растворять многие другие вещества. Вода универсальна и имеет огромное значение в этом мире.
Он состоит из химических элементов водорода и кислорода и существует в твердом, жидком и газообразном состояниях. Не имеет вкуса и запаха при комнатной температуре. Вода обладает способностью растворять многие другие вещества. Вода универсальна и имеет огромное значение в этом мире.
| Параметры сравнения | Ацетон | воды |
| Химическая формула | Химическая формула ацетона C3H6O. | Химическая формула воды h3O |
| Молекулярная масса | Молекулярная масса ацетона 58.08 г/моль. | Молекулярная масса воды 18.02 г/моль |
| Точки кипения и плавления | Температура кипения ацетона 56°С, температура плавления -95°С. | Температура кипения воды 100°С, температура плавления 0°С. |
| Продакшн | Ацетон получают умеренным окислением 2-пропанола в присутствии медного катализатора. | Вода добывается из доступных природных источников. |
| Автозажигание | Самовоспламенение ацетона происходит при 465°С. | Воду нельзя зажечь |
Ацетон, также известный как 2-пропанон или диметилкетон, представляет собой простейший бесцветный, ароматический и легковоспламеняющийся кетон. Ацетон может растворять многие жиры и смолы, а также сложные эфиры целлюлозы.
Ацетон легко смешивается с водой и быстро испаряется на воздухе. Он используется в средствах для снятия лака с ногтей, в текстильной промышленности и при изготовлении лаков.
Ацетон легко смешивается с водой и быстро испаряется на воздухе. Он используется в средствах для снятия лака с ногтей, в текстильной промышленности и при изготовлении лаков.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов в целом признало кетон безопасным, но оно имеет некоторые риски.
Ацетон легко воспламеняется, поэтому его нельзя использовать на открытом огне. Он также может вызывать раздражение при вдыхании. Он также ядовит, если потребляется в больших количествах детьми или даже взрослыми.
Он также может вызывать раздражение при вдыхании. Он также ядовит, если потребляется в больших количествах детьми или даже взрослыми.
Чтобы предотвратить риски, связанные с ацетоном, важно безопасно использовать его в хорошо проветриваемом помещении, держать его подальше от детей, продуктов питания и напитков, плотно закрывать бутылки и использовать средства защиты при его использовании.
Что такое вода?Вода является одним из самых важных соединений, найденных на этой Земле, хотя молекулы Земли выглядят простыми, они очень сложны.
Почти 70% поверхности Земли покрыто водой. Химическая формула воды h30O означает, что одна молекула воды состоит из двух атомов водорода и одного атома кислорода.
Есть три состояния воды: твердое, жидкое и газообразное. Твердое состояние воды известно как лед. Жидкое состояние воды составляет поверхность Земли. Газообразное состояние воды известно как пары.
Существует понятие круговорота воды, который является составной частью других биохимических циклов и влияет на все жизненные процессы на Земле, когда вода меняет свое состояние из одной фазы в другую, но общее число частиц остается неизменным. Существуют различные процессы, при которых вода меняет свое состояние, это может быть испарение, таяние и замерзание, сублимация, конденсация и осаждение. Эти изменения могут произойти с помощью приложения энергии. Круговорот воды оказывает огромное влияние на климат и даже очищает наш воздух.
Существуют различные процессы, при которых вода меняет свое состояние, это может быть испарение, таяние и замерзание, сублимация, конденсация и осаждение. Эти изменения могут произойти с помощью приложения энергии. Круговорот воды оказывает огромное влияние на климат и даже очищает наш воздух.
Вода бесцветна и не имеет вкуса, обладает высокой теплопроводностью и теплотой. Его также называют «универсальным растворителем», так как большая часть вещества растворяется.
Вода находится в различных водоемах, таких как море, океаны, реки, пруды, озера и резервуары. Вода используется для различных целей, от бытовых до сельскохозяйственных и даже используется в промышленности.
Вода широко используется, и поэтому для нас важно сохранить ее и сохранить для будущих поколений. Плотины и сбор дождевой воды помогают экономить воду.
Основные различия между ацетоном и водой- Распространение. Ацетон встречается в животных, растениях, выхлопных газах автомобилей, лесных пожарах, вулканических газах и т.
 д., в то время как вода в основном содержится в океанах и морях, покрывая 71% поверхности Земли.
д., в то время как вода в основном содержится в океанах и морях, покрывая 71% поверхности Земли. - Присутствие в организме человека. Когда в организме после длительного голодания или диеты истощаются запасы углеводов, происходит расщепление жира, в результате чего образуется ацетон, а вода в организме человека составляет 70-75%.
- Токсичность. Ацетон токсичен и вызывает головокружение из-за вдыхания паров, с другой стороны, вода является наименее токсичным соединением.
- Использование- Ацетон применяется в производстве пластмасс, пленочных лент, ацетатного шелка, синтетического каучука, бездымного пороха, некоторых лекарственных средств, для очистки загрязненных поверхностей, в качестве растворителя красок, лаков, различных органических синтетических реакций и т. д. При этом используется вода. в сельском хозяйстве, для промышленных нужд, для производства энергии и бытовых целей.
- Запах – ацетон имеет специфический запах, а вода не имеет никакого запаха.
Заключение
Мы видели разницу между ацетоном и водой. Мы можем понять, что оба они различны по своим формам и способам, и их использование также различается. Их важность по-разному влияет на нашу жизнь, и оба важны для нашего выживания. Мы можем заключить, что ацетон и вода – это не просто химические соединения или вещества, но они имеют свои особенности и свойства, которыми мы не можем просто пренебречь.
Мы можем понять, что оба они различны по своим формам и способам, и их использование также различается. Их важность по-разному влияет на нашу жизнь, и оба важны для нашего выживания. Мы можем заключить, что ацетон и вода – это не просто химические соединения или вещества, но они имеют свои особенности и свойства, которыми мы не можем просто пренебречь.
- https://pubs.rsc.org/en/content/articlehtml/2014/an/c3an00963g
- https://www.sciencedirect.com/science/article/pii/S1383586615000441
Ацетон технический по выгодной цене с доставкой по России
Состав
Ацетон технический ГОСТ 2768-84 изготовлен окислением изопропилового спирта.
Ацетон (диметилкетон, систематическое наименование: пропанон-2) — простейший представитель кетонов. Формула: CH3-C(O)-CH3. Бесцветная легкоподвижная летучая жидкость с характерным запахом. Полностью смешивается с водой и
большинством органических растворителей. Отличается высокой летучестью.
Отличается высокой летучестью.
Назначение
Ацетон применяется в качестве растворителя в различных областях промышленности.
Ацетон хорошо растворяет многие органические вещества (ацетилцеллюлозу и нитроцеллюлозу, жиры, воск, резину и др.), а также ряд солей (хлорид кальция, иодид калия). Используется для синтеза уксусного ангидрида, ацетонциангидрина, дифенилолпропана и других органических продуктов.
Область применения
Область применения ацетона: синтез уксусного ангидрида, ацетонциангидрина, дифенилпропана и других органических продуктов.
Применяется для растворения природных смол, масел, диацетата целлюлозы, полистирола, эпоксидных смол, сополимеров винилхлорида, пошакрилатов, хлоркаучука.
Входит в состав смесевых растворителей: Р-4 (Р-4А), Р-5 (Р-5А), Р-646, Р-647, Р-648 и др.
Используется для обезжиривания поверхности. В чистом виде можно использовать для разбавления грунтовок ЭП-0199 и ЭП-0263, эмалей Эвинал-21, Эвинал-28, ХС-436, Винэп, ХС-510, ЭП-437, ЭП-438.
Ацетон также может применяться для разбавления быстросохнущих лакокрасочных материалов (лаков, красок, эмалей, грунтов, шпаклевок), а также для растворения природных смол, диацетата целлюлозы, полистирола, эпоксидных смол, сополимеров винилхлорида, полиакрилатов, хлоркаучука и проч.
Производится по ГОСТ 2768-84.
Технические характеристики
|
Наименование показателя |
Норма по ГОСТ (ТУ) |
|
Внешний вид и цвет |
Бесцветная прозрачная жидкость |
|
Массовая доля ацетона, %, не менее |
99,5 |
|
Плотность, г/см3/см |
0,789-0,791 |
|
Массовая доля воды, %, не более |
0,5 |
|
Массовая доля метилового спирта, %, не более |
0,15 |
|
Массовая доля кислот в пересчете на уксусную кислоту, %, не более |
0,002 |
|
Устойчивость к окислению марганцево-кислым калием, ч, не менее |
2 |
Рис. 1. Малекула ацетона
1. Малекула ацетона
Стандарт
ГОСТ 2768-84
Характеристики товара
По типу материала
Растворитель / Разбавитель, Прочее
По области применения
Полуфабрикатные материалы, Химическая промышленность
Купить ацетон технический
Химия онлайн @ UTSC
Теория растворимости
Растворимость играет решающую роль в органической химии. Его применение обширно,
начиная от очистки (экстракции) и заканчивая идентификацией неизвестных соединений. это
о последнем пойдет речь. Использование растворимости в качестве средства идентификации требует
преимущество свойств, связанных с определенными функциональными группами. В то время как это делает
не определяет точную химическую структуру, как это делают методы спектроскопии, она обеспечивает
приблизительное представление о присутствующих ключевых функциональных группах и степени углеводородного характера.
Что такое растворимость?
Растворимость можно определить как максимальное количество растворенного вещества, которое может раствориться в фиксированной количество растворителя при определенной температуре. Растворенное вещество – это растворенное вещество, а растворяющее вещество является растворителем.
Что считается «растворенным»?
Растворенное вещество считается «растворенным», когда образуется однородный раствор без взвешенных частиц. частицы. Если растворенное вещество жидкое, между ними не должно быть различимых слоев. растворенное вещество и растворитель. (Совет лаборатории: кладите темный лист бумаги за пробирки при проверке для растворимости.)
Что происходит на молекулярном уровне?
Образование раствора представляет собой трехстадийный процесс, который можно представить на энтальпийной диаграмме:
- Нарушение взаимодействия растворитель-растворитель
- Нарушение взаимодействий растворенных веществ
- Взаимодействие растворенного вещества с растворителем
Этапы 1 и 2 являются эндотермическими процессами, поскольку для разрушения молекулярных взаимодействий требуется энергия.
Если взаимодействие растворенного вещества с растворителем либо ОДИНАКОВО ВЫГОДНО, либо БОЛЕЕ ВЫГОДНО , чем
внутримолекулярных взаимодействий растворенное вещество будет растворяться.
Если межмолекулярные взаимодействия МЕНЕЕ ВЫГОДНЫ , чем внутримолекулярные взаимодействия,
растворенное вещество НЕ БУДЕТ растворяться.
Пример: раствор ацетона в воде
Молекулы ацетона имеют полярную карбонильную группу, которая позволяет им ПРИНИМАТЬ водородные связи от ДРУГИХ соединений.
В ацетоне нет полярных связей C-H или O-H; следовательно, он не может образовывать водородные связи
с другими молекулами ацетона.
Вода, с другой стороны, имеет две полярные связи OH. Слегка положительный заряд каждого водорода может притягивать слегка отрицательные атомы кислорода на других молекулах воды, образуя водородные связи.
Если в воду добавить ацетон, ацетон полностью растворится.
ПОЧЕМУ? Карбонильная группа ацетона может образовывать водородные связи (намного более прочные, чем дисперсионные силы). Не было бы никаких изменений в типе или количестве водородных связей, которые имели бы место с точки зрения воды. Это приводит к более благоприятному взаимодействию растворенного вещества с растворителем, поэтому ацетон переходит в раствор.
ЭМПИРИЧЕСКОЕ ПРАВИЛО :
Для образования раствора: Внутримолекулярные силы < межмолекулярные силы
Факторы, влияющие на растворимость и скорость сольватации:
- Полярность растворенного вещества — определяется функциональными группами, присутствующими в соединении
- Температура — повышение температуры означает более высокую растворимость, поскольку она обеспечивает энергию, необходимую для преодоления неблагоприятные взаимодействия растворенного вещества и растворителя
- Перемешивание — позволяет растворенному веществу и растворителю вступить в контакт для межмолекулярных взаимодействий с образованием
- Площадь поверхности растворенного вещества — чем больше площадь поверхности, тем больше мест для взаимодействия
- Время!!! — обязательно дайте время (~5 минут) для выполнения процесса решения
- Это важно при тестировании неизвестных веществ для предотвращения неточных результатов
Применение растворимости – растворимость по реакции
Растворимость по реакции зависит от наличия функциональной группы и
связанные с ним свойства. Органические кислоты и основания могут реагировать с образованием водорастворимых
соли, переводя соединение в раствор. Тесты, указанные в таблице
(в лабораторном руководстве) обеспечивают средства, с помощью которых ключевые функциональные группы и количество углеводородов
структуру можно определить.
Органические кислоты и основания могут реагировать с образованием водорастворимых
соли, переводя соединение в раствор. Тесты, указанные в таблице
(в лабораторном руководстве) обеспечивают средства, с помощью которых ключевые функциональные группы и количество углеводородов
структуру можно определить.
Проведение тестов на растворимость
О чем следует помнить при выполнении тестов на растворимость:
- Держите крышки бутылок закрытыми — растворитель может поглощать воду из воздуха и делать его более полярным, что приводит к вводящим в заблуждение результатам
- Используйте чистую и сухую стеклянную посуду — предварительно промойте пробирку растворителем, который будет использоваться сразу после
- Доля растворенного вещества в растворителе
- Почему? Часто учащиеся добавляют слишком много растворенного вещества к небольшому количеству растворителя, образуя пересыщенный раствор.
 раствор — соединение на самом деле растворимо, но из-за того, что емкость растворителя превышена, растворенного вещества больше нет
можно растворить. Создается впечатление, что соединение нерастворимо.
раствор — соединение на самом деле растворимо, но из-за того, что емкость растворителя превышена, растворенного вещества больше нет
можно растворить. Создается впечатление, что соединение нерастворимо. - Практикуйте соответствующую пропорцию растворенного вещества к растворителю, чтобы избежать вводящих в заблуждение результатов. Попробуйте протестировать растворимость известного соединения, где результаты можно предсказать, чтобы получить правильные пропорции. В целом, кончика шпателя (или 2 капли) растворенного вещества на 20 капель растворителя будет достаточно.
- Почему? Часто учащиеся добавляют слишком много растворенного вещества к небольшому количеству растворителя, образуя пересыщенный раствор.
- Не выполнять все тесты — цель этих последовательных тестов — сделать выводы на каждом этапе, которые руководство, какие тесты выполнять после.
Тесты
- Вода комнатной температуры (полярный растворитель) — этот тест дает быстрое представление о полярности и количестве атомов углерода в соединении.

- Если растворим : соединение полярное и имеет низкое число атомов углерода (менее 5 атомов углерода). Тестировать
характеристики (кислотные, основные, нейтральные) любых присутствующих функциональных групп используют лакмусовую бумагу.
- Кислотный — соединение, скорее всего, представляет собой карбоновую кислоту. Карбоновые кислоты кислые (pKa~5) потому что образующееся сопряженное основание стабилизировано резонансом через карбонильную группу.
- Основной — соединение, скорее всего, является амином. Амины (РНх3,
R2NH, R3N) способны принимать
протонов из-за неподеленной пары электронов на атоме азота. Более низкая электроотрицательность также позволяет
азот для размещения положительного заряда после протонирования.

- Нейтральный — соединение, скорее всего, является спиртом. Соединение не теряет протон (=кислое) потому что образующийся алкоксид не может стабилизировать отрицательный заряд. Он не получает протон легко потому что электроотрицательность кислорода дестабилизирует положительный заряд, возникающий в результате протонирования.
- Если не растворяется : нагрейте смесь и отметьте, растворится ли она. Если да, проверьте pH и используйте эти выводы для решить, какие дополнительные тесты необходимы для подтверждения этого вывода.
- Если не растворяется в горячей и холодной воде : переходите к правой части таблицы.
- Выводы, которые можно сделать — высокое углеродное число (#C>4), но ничего нельзя сделать относительно
функциональные группы.
 Именно поэтому необходимы дополнительные тесты.
Именно поэтому необходимы дополнительные тесты.
- Выводы, которые можно сделать — высокое углеродное число (#C>4), но ничего нельзя сделать относительно
функциональные группы.
- Если растворим : соединение полярное и имеет низкое число атомов углерода (менее 5 атомов углерода). Тестировать
характеристики (кислотные, основные, нейтральные) любых присутствующих функциональных групп используют лакмусовую бумагу.
- Диэтиловый эфир (только если растворим в воде) — цель этого теста — различить неорганические соли и органические соединения.
- Если растворим : соединение является ОРГАНИЧЕСКИМ, поскольку углеводородная часть, даже небольшая, взаимодействует с эфиром
- Если нерастворим : соединение является НЕОРГАНИЧЕСКИМ, потому что в нем нет углеводородной части, которую можно было бы перевести в раствор.
- 5% HCl — этот тест проверяет наличие основных функциональных групп с использованием сильной кислоты.
- Если растворим : скорее всего амин с высоким числом атомов углерода.

- Почему? Может иметь место кислотно-щелочная реакция с образованием органической соли, которая теперь растворима в воде.
Следовательно, неизвестное соединение теперь может перейти в раствор.
- Почему? Может иметь место кислотно-щелочная реакция с образованием органической соли, которая теперь растворима в воде.
Следовательно, неизвестное соединение теперь может перейти в раствор.
- Если нерастворим : Соединение либо кислое, либо нейтральное с высоким числом атомов углерода. Больше испытаний требуется для определения кислотности или нейтральности любых функциональных групп.
- Если растворим : скорее всего амин с высоким числом атомов углерода.
- 5% NaOH — этот тест проверяет наличие кислотных функциональных групп с использованием сильного основания.
- Если растворим : соединение может быть ЛИБО карбоновой кислотой с высоким числом атомов углерода, либо фенолом.
Последующие тесты необходимы для определения степени кислотности.

- Если нерастворим : соединение нейтральное с высоким числом атомов углерода. Требуется испытание серной кислотой.
- Если растворим : соединение может быть ЛИБО карбоновой кислотой с высоким числом атомов углерода, либо фенолом.
Последующие тесты необходимы для определения степени кислотности.
- 5%NaHCO3 — этот тест, по сути, проверяет, НАСКОЛЬКО кислотным является соединение. Гидрокарбонат натрия является слабым основанием,
и реакция нейтрализации завершится только в том случае, если она прореагирует с сильной кислотой.
- Если растворим : соединение, скорее всего, представляет собой карбоновую кислоту с высоким числом атомов углерода.
- Если нерастворим : соединение, скорее всего, является фенолом
Почему карбоновая кислота более кислая, чем фенол?
Если фенол теряет протон, результирующие резонансные структуры на феноксиде образуют отрицательные заряды на атомах углерода.
 В карбоксилат-ионе резонансные структуры возникают, когда электронная плотность локализована на кислороде.
Кислород более электроотрицательный, чем углерод, поэтому он может более эффективно аккумулировать дополнительный отрицательный заряд.
что делает его более слабым сопряженным основанием и, следовательно, более сильной кислотой.
В карбоксилат-ионе резонансные структуры возникают, когда электронная плотность локализована на кислороде.
Кислород более электроотрицательный, чем углерод, поэтому он может более эффективно аккумулировать дополнительный отрицательный заряд.
что делает его более слабым сопряженным основанием и, следовательно, более сильной кислотой.
- Если растворим : соединение, скорее всего, представляет собой карбоновую кислоту с высоким числом атомов углерода.
- h3SO4 — этот тест позволяет отличить карбонильные соединения от чисто углеводородных соединений.
- Если растворим : соединение имеет карбонильную группу или некоторую степень ненасыщенности. Это может быть альдегид, кетон, сложный эфир, амид или ненасыщенное соединение.
- Если нерастворим : соединение не имеет полярных функциональных групп и поэтому не реагирует с кислотой.
 Следовательно, это, скорее всего, крупная углеводородная структура.
Следовательно, это, скорее всего, крупная углеводородная структура.
Пример
Бензойная кислота. Какие тесты вы бы провели и каких результатов ожидаете?
Разгадка химической тайны №8: Go Blue!
Предисловие : Я предлагаю задание, основанное на этой тайне. Если вы хотите узнать больше об этой задаче, обязательно прочитайте раздел Challenge в конце этого сообщения в блоге.
Поздравляем Гражину Зреду и Альфредо Тифи, которые разгадали химическую тайну №8. Хотя ни Гражина, ни Альфредо точно не выяснили, как я провернул этот трюк, они оба определили, что я использовал явление «высаливания». В опыте «высаливания» к смеси воды и водорастворимой органической жидкости добавляют водорастворимую ионную соль. При добавлении достаточного количества соли смесь разделяется на два слоя: один, богатый водой, и другой, богатый органической жидкостью. 1 Вы можете увидеть, как это работает (а также решение Загадки №8) в видео ниже:
1 Вы можете увидеть, как это работает (а также решение Загадки №8) в видео ниже:
В Загадке №8 я использовал ацетон в качестве водорастворимой органической жидкости и поваренную соль в качестве ионного вещества. Сначала я смешал ацетон, воду и два разных красителя без добавления соли. Желтый краситель был получен из желтого пищевого красителя, а синий краситель был получен из синего блеска. Краситель на синих блестках очень хорошо растворяется в ацетоне, но не так хорошо в воде. Другой желтый краситель очень хорошо растворяется в воде, но не так хорошо в ацетоне.
Ацетон и вода хорошо растворяются друг в друге благодаря взаимодействию водородных связей между атомом кислорода в молекулах ацетона и связью O-H в молекулах воды (рис. 1).
Рисунок 1: Изображение водородной связи (желтая пунктирная линия), образованной между молекулой ацетона (нижняя молекула) и молекулой воды (верхняя молекула).
Изображение сделано с помощью программы моделирования Odyssey.
Все четыре компонента очень хорошо смешаны друг с другом (ацетон, вода, синий краситель, желтый краситель) с образованием раствора зеленого цвета. При добавлении большого количества поваренной соли зеленый раствор разделялся на два слоя: синий, насыщенный ацетоном слой сверху и желтый, насыщенный соленой водой слой снизу. Как это произошло?
При растворении соли в смеси образовавшиеся ионы Na + и Cl – очень сильно взаимодействовали с молекулами воды за счет ионно-дипольных сил (рис. 2). Эти ионно-дипольные взаимодействия притягивали молекулы воды гораздо сильнее, чем водородные связи ацетон-вода. В результате ионно-дипольные силы оторвали молекулы воды от молекул ацетона, и жидкости разделились на две отдельные фазы. Желтый краситель, который лучше растворяется в воде, чем в ацетоне, оказался в слое соленой воды. Синий краситель, который лучше растворяется в ацетоне, оказался в ацетоновом слое.
Рис. 2: Ион хлорида (зеленый) взаимодействует с шестью молекулами воды через ионно-дипольные силы (желтая пунктирная линия). Изображение сделано с помощью программы моделирования Odyssey.
Что интересно в этом проекте, так это то, что можно использовать множество различных комбинаций красителей, органических жидкостей и солей для достижения различных эффектов. Например, Гразня Зреда «разгадала» эту загадку, сообщив, что она смешала желтый пищевой краситель, воду, синий пищевой краситель (вместо синего красителя на блестках), изопропиловый спирт (вместо ацетона) и карбонат калия (в место соли). При смешивании этих предметов наблюдался красивый зеленый раствор; добавление карбоната калия разделило смесь на синий и зеленый слои (рис. 3).
Рисунок 3: Эксперимент, проведенный одним из учеников Гражины Зреды. Слева направо: пробирки, содержащие желтый пищевой краситель в воде и синий пищевой краситель в 70% изопропиловом спирте; Смешивание желтой и синей жидкостей с образованием зеленого раствора; Добавление карбоната калия для образования зеленого раствора; разделение на синий и желтый слои при растворении карбоната калия.
Мы с Гражиной начали общаться в Твиттере об этих экспериментах, и однажды днем мы даже провели час или два «вместе», обмениваясь электронными сообщениями о различных экспериментах, которые мы проводили. Это было действительно очень весело! Благодаря нашим совместным усилиям мы обнаружили несколько действительно интересных вещей. Во-первых, в версии этого эксперимента Гражины можно использовать только зеленый пищевой краситель (вместо синего и желтого)! Это потому, что зеленый пищевой краситель содержит комбинацию синего и желтого пищевых красителей. Во-вторых, использование различных смесей органической жидкости и ионных солей с синим пищевым красителем и фиолетовым пищевым красителем «осеннего цвета» привело к совершенно разным результатам (рис. 4).
Рисунок 4: Цветовые комбинации, полученные с использованием синего пищевого красителя, фиолетового пищевого красителя «осеннего цвета» в сочетании с (слева) ацетоном, солью и водой; (справа) изопропиловый спирт, карбонат калия и вода.


 д., в то время как вода в основном содержится в океанах и морях, покрывая 71% поверхности Земли.
д., в то время как вода в основном содержится в океанах и морях, покрывая 71% поверхности Земли. раствор — соединение на самом деле растворимо, но из-за того, что емкость растворителя превышена, растворенного вещества больше нет
можно растворить. Создается впечатление, что соединение нерастворимо.
раствор — соединение на самом деле растворимо, но из-за того, что емкость растворителя превышена, растворенного вещества больше нет
можно растворить. Создается впечатление, что соединение нерастворимо.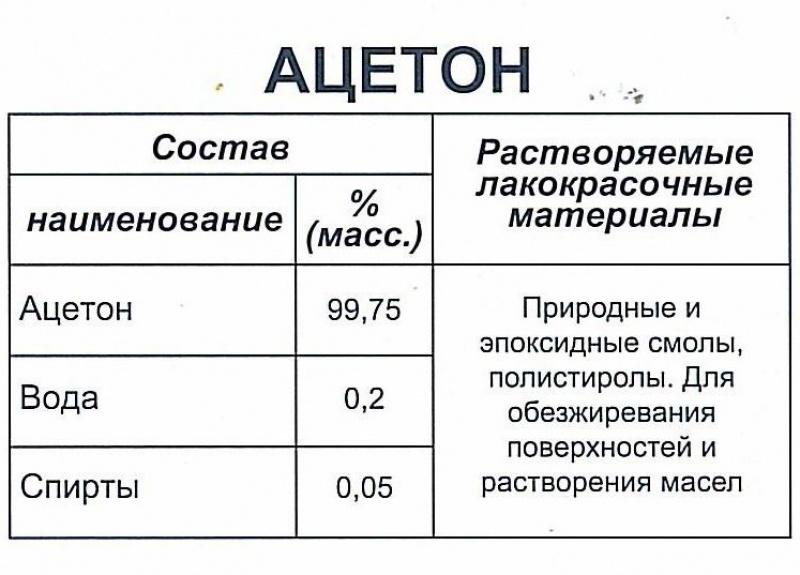

 Именно поэтому необходимы дополнительные тесты.
Именно поэтому необходимы дополнительные тесты.

 В карбоксилат-ионе резонансные структуры возникают, когда электронная плотность локализована на кислороде.
Кислород более электроотрицательный, чем углерод, поэтому он может более эффективно аккумулировать дополнительный отрицательный заряд.
что делает его более слабым сопряженным основанием и, следовательно, более сильной кислотой.
В карбоксилат-ионе резонансные структуры возникают, когда электронная плотность локализована на кислороде.
Кислород более электроотрицательный, чем углерод, поэтому он может более эффективно аккумулировать дополнительный отрицательный заряд.
что делает его более слабым сопряженным основанием и, следовательно, более сильной кислотой. Следовательно, это, скорее всего, крупная углеводородная структура.
Следовательно, это, скорее всего, крупная углеводородная структура. Изображение сделано с помощью программы моделирования Odyssey.
Изображение сделано с помощью программы моделирования Odyssey.
